| Wodór |
|
 | Wodór świecący w lampie wyładowczej |
Wodór świecący w
lampie wyładowczej
|
| Dane ogólne |
| Nazwa, symbol,
l.a.
| Wodór, H, 1 |
| Grupa, okres, blok |
1
, 1,
s
|
| Właściwości metaliczne |
niemetal
|
|
|
|
| Najbardziej stabilne izotopy |
|---|
|
|
Jeżeli nie podano inaczej, dane dotyczą
warunków normalnych (0 °C, 1013,25 hPa)
|
Wodór (H, łac. hydrogenium) –
pierwiastek chemiczny
,
niemetal
z
bloku s
układu okresowego
. Jest to najprostszy możliwy pierwiastek o
liczbie atomowej
1, składający się z jednego
protonu
i jednego
elektronu
.
Rozpoczyna
układ okresowy
. Jest wyznacznikiem w
szeregu aktywności metali
, który oddziela metale wypierające wodór i na niewypierające go.
Istnieje w postaci dwóch stabilnych
izotopów
1H (prot) i 2H (
deuter
, D) oraz niestabilnego – 3H (
tryt
, T).
Mimo iż wodór jest niemetalem, w warunkach wysokiego ciśnienia przechodzi do stanu
metalicznego
.
Występowanie
Wodór jest
najpowszechniej występującym pierwiastkiem we Wszechświecie
. Występuje w gwiazdach i obłokach międzygwiazdowych.
W stanie wolnym występuje w postaci gazowych
cząsteczek
dwuatomowych H2, tworząc
wodór cząsteczkowy
. Na Ziemi w tej postaci występuje w górnej warstwie atmosfery (0,9%).
W postaci związanej wchodzi w skład wielu
związków nieorganicznych
(np.:
wody
,
kwasów
,
zasad
,
wodorotlenków
) oraz
związków organicznych
(
węglowodory
i ich pochodne).
Kation wodorowy
Kation
wodorowy H+ jest w istocie równoważny
protonowi
. W stanie wolnym występuje on w próżni,
plazmie
i górnych warstwach atmosfery ziemskiej (promienie UV
jonizują
atomy wodoru). W roztworach wodnych kation ten jest natychmiast
solwatowany
do
jonu hydroniowego
H3O+:
- H+ + H2O → H3O+
Czasami, w równaniach
dysocjacji elektrolitycznej
podaje się uproszczenie H3O+ i pisze się po prostu H+, co zupełnie mija się z prawdą. Z tego względu należy pamiętać, że
skala pH
jest miarą aktywności jonów hydroniowych, a nie wodorowych.
Serie widmowe
Wodór ma charakterystyczne serie widmowe:
-
seria Lymana
-
seria Balmera
-
seria Paschena
-
seria Bracketta
-
seria Pfunda
-
seria Humphreysa
Historia
Prawdopodobnie pierwszą osobą, która opisała otrzymywanie wodoru w stanie czystym był
alchemik
Paracelsus
żyjący w latach
1493
–
1541
. Paracelsus wykonywał eksperymenty polegające na wrzucaniu metali do kwasów i zbieraniu do naczyń gazowych produktów tych reakcji, co do dzisiaj stanowi najprostszy sposób otrzymywania tego pierwiastka w warunkach laboratoryjnych. Przypuszcza się jednak, że podobne eksperymenty wykonywano już wcześniej.
Eksperymenty te powtórzył w
1661
r.
Robert Boyle
, który opisał też wybuchową naturę mieszanki wodoru z powietrzem, zwanej dziś
mieszaniną piorunującą
, a wówczas aria tonante – z włoskiego – "powietrze grzmiące". Pierwszą osobą, która uznała wodór za pierwiastek, a właściwie
flogiston
, czyli "pierwiastek palności", będący przedmiotem błędnej teorii flogistonowej i reliktem wielowiekowej tradycji alchemii, był
Henry Cavendish
. W
1766
r. zamieścił w swoich notatkach taką tezę. Jak wszystkie inne badania angielskiego arystokraty nie zostało to jednak opublikowane za jego życia. Substancja ta została uznana za pierwiastek dzięki badaniom
Antoine Lavoisiera
nad otrzymywaniem wody z wodoru i
tlenu
w
1783
r. Pierwotnie polska nazwa, przetłumaczona z łaciny przez
Jędrzeja Śniadeckiego
brzmiała "wodoród". Nazwę tą przyjęli także Chodkiewicz,
Fonberg
, Krzyżanowski i Radwański, który używał także nazwy "lżeń". W projekcie warszawskim określano nowy pierwiastek mianem "wodor", Matecki pisał "wód", a
Czyrniański
"wod", następnie także "wód". Z biegiem czasu została skrócona do powszechnie dziś znanej którą Jako pierwszy nazwę "wodór" zaproponował
Filip Walter
, co zatwierdziła krakowska
Akademia Umiejętności
w roku
1900
.
Otrzymywanie
Na skalę przemysłową wodór otrzymuje się następującymi metodami:
- Poprzez konwersję realizowaną podczas przepuszczania alkanu nad parą wodną:
- CxH2y + 2xH2O → (2x+y)H2 + xCO2
- CH4 + 2H2O → 4H2 + CO2
- C + H2O → CO + H2
- 2CH4 –T=2000 °C→ C2H2 + 3H2
- 2CH4 + O2 → 2CO + 4H2
W laboratorium można go otrzymać na kilka sposobów:
- 2H2O → 2H2 +O2
- np. Zn + 2HCl → ZnCl2 + H2↑
- Spalanie magnezu w parze wodnej:
- Mg + H2O → MgO + H2↑
- np. 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Powyższe reakcje
roztwarzania
metali wykonywać można dogodnie w
aparacie Kippa
.
Izotopy wodoru
Wodór występuje w 3 różnych
izotopach
: prot, deuter i tryt.
W skład jądra wchodzi jeden proton. Nie posiada neutronów. Jest izotopem stabilnym
W skład jądra wchodzi 1 proton i jeden neutron. Jest izotopem stabilnym. Ze względu na to, że deuter ma dwukrotnie większą masę od protu, różnią się one znacząco właściwościami fizycznymi, a także chemicznymi (silny
efekt izotopowy
).
W skład jądra wchodzi jeden proton i 2 neutrony. Jest izotopem niestabilnym. Ulega
rozpadowi β-
z powstaniem
helu
-3.
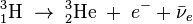
Zastosowanie
Dawniej wodór był stosowany do napełniania balonów
sterowców
, lecz z powodu jego łatwości wybuchu zrezygnowano z dalszego napełniania wodorem. Skroplony wodór znalazł zastosowanie jako
paliwo
w
silnikach rakietowych
. Jest tak lekki, że nie potrzeba pomp, aby napełniać nim zbiorniki promu kosmicznego. Naukowcy pracują nad możliwością stworzenia
ogniw paliwowych
napędzanych wodorem, które mogłyby służyć jako źródło napędu dla wielu pojazdów i urządzeń. Izotop wodoru –
tryt
– wykorzystywany jest w reakcjach termojądrowych, które mogą potencjalnie stanowić źródło taniej i czystej energii. Inny jego izotop –
deuter
– wykorzystywany jest jako spowalniacz (
moderator
)
w reaktorach atomowych
. Związki zawierające deuter są wykorzystywane do przygotowanie próbek
NMR
ze względu na właściwości fizykochemiczne tego atomu.
Wodór używany jest także w elektrowniach do chłodzenia generatorów dużej mocy (powyżej 500 MW)[1].
W chemii organicznej wodór może być użyty do:
- C2H4 + H2 → C2H6
- redukcji związków tlenowych
Związki wodoru
Przypisy
Zobacz też
Bibliografia
- "Księga pierwiastków", Ignacy Eichstaedt, wydanie III, Warszawa 1973.
Linki zewnętrzne