Hydroliza soli -
reakcja chemiczna
zachodząca zaraz po
dysocjacji elektrolitycznej
soli
w trakcie rozpuszczania ich w
wodzie
. Reakcja ta powoduje, że roztwory wielu soli nie mają obojętnego
pH
lecz są bardziej lub mniej kwaśne lub zasadowe.
Powstające w wyniku dysocjacji soli
jony
są z punktu widzenia teorii Lewisa
kwasami
(
kationy
) lub
zasadami
(
aniony
), mogą więc one reagować z wodą tak, jakby były kwasami i zasadami w tradycyjnym rozumieniu (wg
teorii Arrheniusa
). To właśnie ta reakcja jest zwana hydrolizą elektrolityczną soli. Przebiega podobnie do reakcji innych słabych
elektrolitów
, a więc w przybliżeniu zgodnie z
prawem rozcieńczeń Ostwalda
.
Warto pamiętać, iż w przypadku soli mocnego kwasu i mocnej zasady hydroliza nie zachodzi. Nie zachodzi także w przypadku soli, które są nierozpuszczalne w wodzie.
Sól mocnego kwasu i słabej zasady
W przypadku soli mocnego kwasu i słabej zasady, jak np.
chlorku amonowowego
, (NH4Cl), kation NH4+ wchodząc w reakcję z wodą spełnia funkcję kwasu odtwarzając w roztworze słabą zasadę,
amoniak
, NH3 (czyli NH3*H2O) oraz wytwarzając
jony hydroniowe
H3O+:

Stała równowagi
tej reakcji jest w praktyce równa stałej dysocjacji kwasowej
jonu amonowego
:

![K_{h} = \frac{[H_{3}O^{+}]\cdot[NH_{3}]}{[NH_{4}^{+}]}](http://upload.wikimedia.org/math/1/2/d/12d0538fb2310cd9db03063716647ab0.png)
gdyż udział produktów
autodysocjacji wody
jest w tym przypadku pomijalny. W związku z tym zgodnie z prawem Ostwalda można zapisać:

gdzie:
![[H_{3}O^{+}] = [NH_{4}^{+}] = \alpha_{h} C_{soli}](http://upload.wikimedia.org/math/7/a/4/7a42462b28edc97b1768de3bd7694ff1.png)
- αh - stopień hydrolizy
- Kw - iloczyn jonowy wody
- Ka, Kb - stałe dysocjacji kwasowej i zasadowej
- Kh - stała równowagi hydrolizy i pKh = − log10Kh
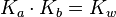 dla sprzężonej pary kwas-zasada
dla sprzężonej pary kwas-zasada- pKa + pKb = pKw, gdzie
p jest operatorem
: pX = -log10(X)
Sól słabego kwasu i mocnej zasady
Dla soli słabego kwasu i mocnej zasady (np.
octanu sodu
, CH3COONa), anion
octanowy
CH3COO- wchodzi w reakcję z cząsteczką wody z wytworzeniem cząsteczki
kwasu octowego
CH3COOH i
anionu wodorotlenowego
:

Stała równowagi hydrolizy jest w praktyce równa stałej dysocjacji zasadowej jonu octanowego:

![K_{h} = \frac{[OH^{-}]\cdot[CH_{3}COOH]}{[CH_{3}COO^{-}]}](http://upload.wikimedia.org/math/b/2/1/b214e10a4c5e68f154ce30ac7726ea11.png)
Co po pominięciu produktów autodysocjacji wody i zostosowaniu prawa Ostwalda daje:

gdzie:
- [OH − ] = [CH3COOH] = αhCsoli
Sól słabej zasady i słabego kwasu
Jeżeli dana sól jest solą jednocześnie słabej zasady i słabego kwasu, wówczas podane poniżej równania komplikują się, gdyż powstające kationy i aniony są jednocześnie silnymi kwasami i zasadami Lewisa i prawo rozcieńczeń Ostwalda przestaje być dla nich spełnione.
Zobacz też