|
Równanie Clapeyrona (stan gazu doskonałego)
Równanie Clapeyrona (stan gazu doskonałego)Równanie Clapeyrona, równanie stanu gazu doskonałego to
równanie stanu
opisujące związek pomiędzy temperaturą, ciśnieniem i objętością
gazu doskonałego
, a w sposób przybliżony opisujący
gazy rzeczywiste
. Sformułowane zostało w 1834 roku przez
Benoîta Clapeyrona
. Prawo to można wyrazić wzorem 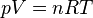
gdzie: Równanie to jest wyprowadzane na podstawie założeń: - gaz składa się z poruszających się cząsteczek;
- cząsteczki zderzają się ze sobą oraz ze ściankami naczynia w którym się znajdują;
- brak oddziaływań międzycząsteczkowych w gazie, z wyjątkiem odpychania w momencie zderzeń cząsteczek;
- objętość (rozmiary) cząsteczek jest pomijana;
- zderzenia cząsteczek są
doskonale sprężyste
;
Równanie to, mimo że wyprowadzone na podstawie założeń, które nigdy nie są spełnione, dobrze opisuje większość substancji
gazowych
w obszarze ciśnień do ok. 100
atmosfer
i temperatury do 300–400 °C, oraz w temperaturze trochę większej od temperatury skraplania gazu. Z równania tego wynika fundamentalny związek między ciśnieniem, temperaturą i liczbą cząstek gazu, z którego wynikają trzy wnioski: - n moli (taka sama liczba cząstek) gazu, przy danej temperaturze i ciśnieniu panującym w naczyniu zajmuje zawsze taką samą objętość, niezależnie od budowy chemicznej tego gazu (V = nRT/p).
- w danej objętości, przy danym ciśnieniu i temperaturze, znajduje się zawsze taka sama liczba moli cząsteczek gazu, niezależnie od jego budowy chemicznej (n = pV/RT)
- n moli gazu zamkniętych w naczyniu o określonej objętości, przy określonej temperaturze, będzie wywierał na jego ścianki zawsze jednakowe ciśnienie, niezależnie od tego, jaki to jest gaz (p = nRT/V).
Określenie równanie Clapeyrona nie jest stosowane powszechnie w odniesieniu do tego wzoru – w literaturze anglojęzycznej równanie to znane jest jedynie jako ideal gas law (prawo gazu doskonałego), podobnie jest w większości innych języków. W
Rosji
równanie to funkcjonuje pod nazwą równania
Mendelejewa
-Clapeyrona.
Równanie Clapeyrona
opisuje przemiany fazowe, m.in. ciecz-gaz. Pod tą nazwą często funkcjonuje też
równanie Clausiusa-Clapeyrona
. Rozszerzeniami równania gazu doskonałego, uwzględniającymi objętość cząsteczek gazu oraz przyciąganie cząsteczek, są
równanie van der Waalsa
oraz
wirialne równanie stanu
. - Przemiany termodynamiczne
Zobacz też-
termodynamika
Linki zewnętrzne
Inne hasła zawierające informacje o "Równanie Clapeyrona (stan gazu doskonałego)":
Nadciśnienie tętnicze
...
Adwentyzm
...
Uznam
...
Fosforan wapnia
...
1972
...
Kwas fosforowy
...
Diakon
...
Aurora
...
Nowa Polityka Ekonomiczna
...
Nowa Anglia
...
Inne lekcje zawierające informacje o "Równanie Clapeyrona (stan gazu doskonałego)":
21 Alkohol i inne używki. Kolizje i wypadki (plansza 1)
...
21 Alkohol i inne używki. Kolizje i wypadki (plansza 2)
...
20 Zachowanie się na drodze wobec pieszych i rowerzystów (plansza 3)
...
|