Reakcje stężonego kwasu siarkowego (VI) z metalami, mniej aktywnymi niż wodór:
Cu + 2 H2SO4 --> CuSO4 + SO2 + 2 H2O
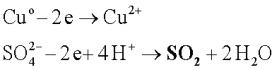 Reakcja metalu aktywniejszego od wodoru ze stężonym H2SO4
Reakcja metalu aktywniejszego od wodoru ze stężonym H2SO4
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O
W przypadku HNO
3 stopień redukcji azotu zależy przede wszystkim od aktywności metalu, warunków reakcji, stężenia kwasu.(NH
3, N
2O, NO, NO
2)
W reakcjach
rozcieńczonego(1-2%) HNO3 z bardzo aktywnymi metalami (K, Na, Mg) wydziela się wodór, ponieważ metale te reagują z wodą, tworząc wodorotlenek i wodór, Utworzony wodorotlenek, reaguje dalej z HNO
3 na zasadzie reakcji zobojętniania. Metale, które w normalnym warunkach praktycznie nie reagują z wodą, typu Zn, Fe, Ni, Pb zawsze reagują z HNO
3 na zasadzie redukcji reszty kwasowej.
4Zn + 10HNO3 → NH4NO3 + 4Zn(NO3)2 + 3H2O (stężony HNO3)