Model budowy atomu Bohra – model
atomu
wodoru
autorstwa
Nielsa Bohra
. Bohr przyjął wprowadzony przez
Ernesta Rutherforda
model atomu, według tego modelu
elektron
krąży wokół
jądra
jako naładowany
punkt materialny
, przyciągany przez jądro
siłami elektrostatycznymi
. Przez analogię do ruchu
planet
wokół
Słońca
model ten nazwano "modelem planetarnym atomu".
Postulaty Bohra
Bohr, budując swój model atomu, przyjął dwa postulaty, bez których model ten nie byłby zgodny z doświadczeniem. Postulaty te miały w istocie charakter kwantowy, ale były wprowadzone
ad hoc
.
- Orbitalny moment pędu elektronu jest skwantowany. Może on przybierać dyskretne wartości

- gdzie
- n = 1,2,3...,
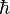 –
stała Plancka
podzielona przez 2π.
–
stała Plancka
podzielona przez 2π.
- Podczas zmiany orbity, której towarzyszy zmiana energii elektronu, atom emituje foton. Energia fotonu równa jest różnicy między energiami elektronu na tych orbitach

- gdzie
- E2 i E1 – energie elektronu, odpowiednio, końcowa i początkowa,
- h – stała Plancka,
- ν - częstotliwość fotonu.
Konsekwencje postulatów
Z postulatów tych wynika, że promienie orbit elektronu oraz energie elektronu na poszczególnych orbitach są również skwantowane. Promienie te, w szczególności promień atomu wodoru w stanie podstawowym, tzw.
promień atomu Bohra
, oraz energie można obliczyć z klasycznego przyrównania siły elektrostatycznej do
siły dośrodkowej
.
Zatem elektron może krążyć tylko po określonych orbitach zwanych stabilnymi (stacjonarnymi), ponadto – krążąc po tych orbitach – nie emituje promieniowania, mimo że z praw klasycznej elektrodynamiki wynika, że ładunek krążąc po orbicie stale powinien emitować promieniowanie elektromagnetyczne. W tym modelu promieniowanie jest emitowane tylko wówczas, gdy elektron zmienia orbitę.
Model Bohra, jakkolwiek będący sztucznym połączeniem mechaniki klasycznej i ograniczeń kwantowych, daje prawidłowe wyniki dotyczące wartości
energii
elektronu na kolejnych orbitach i promieni tych orbit w przypadku atomu wodoru i atomów pierwiastków wodoropodobnych.
Odrzucenie modelu Bohra
Mimo pozornej poprawności modelu zrezygnowano z niego, ponieważ zgodnie z
elektrodynamiką klasyczną
poruszający się po okręgu (lub elipsie), a więc przyspieszany, elektron powinien, w sposób ciągły, wypromieniowywać energię i w efekcie "spadłby" na jądro już po czasie rzędu 10–6 sekundy. Fakt, że tak się nie dzieje, nie dawał się wytłumaczyć na gruncie fizyki klasycznej. Model Bohra został ostatecznie odrzucony również ze względu na to, że nie dawało się go zaadaptować do opisu atomów posiadających więcej niż dwa elektrony i nie można było za jego pomocą stworzyć przekonującej, zgodnej ze znanymi faktami eksperymentalnymi, teorii powstawania
wiązań chemicznych
.
Zobacz też