| Benzen |
|
|
| Ogólne informacje |
| Inne nazwy | cykloheksa-1,3,5-trien[1], benzol |
| Wzór sumaryczny | C6H6 |
|
SMILES
| c1ccccc1
C1=CC=CC=C1 |
|
Masa molowa
| 78,11
g
/
mol
|
| Wygląd | bezbarwna ciecz o intensywnym słodkawym zapachu |
| Identyfikacja |
|
Numer CAS
| 71-43-2 |
|
PubChem
| 241[2] |
|
|
| Niebezpieczeństwa |
|
MSDS
|
Zewnętrzne dane MSDS
|
| Zagrożenia wg
Dyrektywy 67/548/EWG
, zał. I[3] |
 | Łatwopalny |
|  | Toksyczny |
| Łatwopalny
(F) | Toksyczny
(T) |
|
|
NFPA 704
| |
|
Temperatura zapłonu
| -11
°C
|
|
Temperatura samozapłonu
| 561
°C
|
|
Zwroty ryzyka
| R45, R46, R11, R36/38, R48/23/24/25, R65 |
|
Zwroty bezpieczeństwa
| S53, S45 |
|
Numer RTECS
| CY1400000 |
| Podobne związki |
|
Pochodne
aromatyczne |
toluen
,
ksylen
,
fenol
|
| Podobne związki |
naftalen
,
antracen
,
naftacen
,
pentacen
,
pirydyna
,
borazyna
|
Jeżeli nie podano inaczej, dane dotyczą
warunków standardowych (25 °C, 1000 hPa)
|
Znaczek pocztowy
wydany w 150 rocznicę urodzin Friedricha Augusta Kekulégo, który zaproponował model struktury benzenu
Benzen (C6H6) to
organiczny
związek chemiczny
z grupy
arenów
. Jest to najprostszy karbocykliczny, obojętny
węglowodór aromatyczny
.
Właściwości
W temperaturze pokojowej benzen jest bezbarwną
cieczą
o charakterystycznym, ostrym
zapachu
. Bardzo słabo
rozpuszcza
się w
wodzie
, natomiast lepiej w
rozpuszczalnikach
organicznych. Sam jest dobrym rozpuszczalnikiem dla
wosków
,
tłuszczów
,
naftalenu
i innych niepolarnych związków chemicznych. Pali się kopcącym
płomieniem
, a jego
ciepło spalania
wynosi 9470
kcal
/
kg
.
Benzen jest związkiem trwałym chemicznie, w przeciwieństwie do
alkenów
nie ulega łatwo reakcji
addycji
. Stosunkowo łatwo natomiast zachodzi
substytucja elektrofilowa
do pierścienia aromatycznego. Przykładem może być reakcja alkilowania i acylowania, katalizowana
kwasami Lewisa
, nazywana
reakcją Friedla-Craftsa
.
W większych ilościach benzen jest
toksyczny
.
LD50
(szczur, doustnie) wynosi 930 mg/kg,
LC50
(szczur, inhalacja) – 10 000 ppm przez 7 h. Ma silne właściwości rakotwórcze. Po spożyciu powoduje podrażnienie
śluzówki
żołądka
, mdłości i
wymioty
. Przy pochłonięciu większych ilości powoduje bóle głowy, drgawki i zgon.
Nieorganicznym
analogiem
benzenu jest
borazyna
.
Historia
Benzen został po raz pierwszy wyodrębniony przez
Michaela Faradaya
w
1825
r. ze sprężonego
gazu świetlnego
będącego oleistą pozostałością zbierającej się na dnie londyńskich gazowych lamp ulicznych. W
1845
inny angielski chemik, Charles Mansfield, pracując pod kierunkiem
Augusta Wilhelma von Hofmanna
, wyodrębnił go ze
smoły węglowej
. Cztery lata później Mansfield rozpoczął produkcję benzenu na skalę przemysłową bazując na tej metodzie.
Struktura
Struktura Kekulégo
Problem budowy benzenu interesował chemików już od chwili wyodrębnienia tego związku.
W
1865
r. niemiecki chemik
Friedrich August Kekulé
wysunął
hipotezę
, że benzen jest cykloheksatrienem o sześcioczłonowym pierścieniu, w którym pomiędzy atomami węgla na przemian występują wiązania pojedyncze i podwójne[4]:
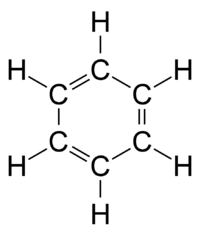 |
Struktura Kekulégo |
.
Struktura Kekulégo nie tłumaczyła jednak dlaczego benzen i inne związki aromatyczne nie posiadają właściwości charakterystycznych dla węglowodoru nienasyconego. Ponadto, w miarę gromadzenia się materiału eksperymentalnego, okazywało się że wszystkie wiązania C-C w pierścieniu benzenowym są równocenne. Na podstawie badań
spektroskopowych
ustalono, że cząsteczka benzenu w istocie stanowi pierścień złożony z sześciu atomów węgla połączonych równocennymi wiązaniami o długości pośredniej pomiędzy długością wiązania pojedynczego (1,54 Å) i podwójnego (1,34 Å) – 1,39 Å. Stan ten można przedstawić z pomocą struktury rezonansowej:
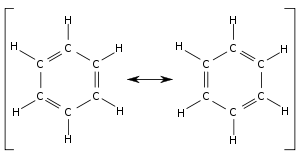 |
Struktura rezonansowa benzenu |
Mechanika kwantowa
Zagadnienie budowy pierścienia benzenowego dobrze tłumaczy
kwantowomechaniczna
metoda orbitali molekularnych
. Przyjmuje się
hybrydyzację
sp² dla atomów węgla. Zhybrydyzowane orbitale tworzą wiązania σ C-C i C-H. Pozostałe orbitale p atomów węgla (o osiach prostopadłych do płaszczyzny cząsteczki) tworzą zdelokalizowane wiązanie π:
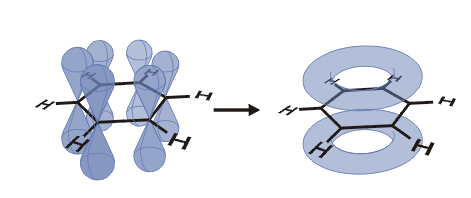 |
Powstawanie zdelokalizowanego orbitalu molekularnego benzenu |
Otrzymywanie
Do czasów
II wojny światowej
główną metodą otrzymywania benzenu była
ekstrakcja
ze
smoły pogazowej
(produkt uboczny w przemyśle koksowniczym i gazowniczym). W
latach 50. XX wieku
wzrosło zapotrzebowanie na benzen, głównie ze strony przemysłu tworzyw sztucznych i konieczna stała się jego produkcja na wielką skalę z
ropy naftowej
.
Obecnie, oprócz ekstrakcji ze smoły pogazowej, stosuje się następujące metody otrzymywania benzenu:
- C6H5CH3 + H2 → C6H6 + CH4
Inne, nie stosowane na skalę przemysłową metody pozyskiwania tego związku to m.in.:
- 3C2H2 → C6H6
Zastosowanie
Benzen jest jednym z najważniejszych surowców w syntezie organicznej, służy m.in. do produkcji
tworzyw sztucznych
, włókien syntetycznych,
barwników
,
leków
,
detergentów
,
pestycydów
, a także do otrzymywania
aniliny
,
fenolu
i
acetonu
(
metoda kumenowa
) oraz
bezwodnika maleinowego
.
Sam benzen jest ze względu na swoje właściwości toksyczne i rakotwórcze rzadko używany. Był niegdyś masowo stosowany jako rozpuszczalnik dla wielu reakcji prowadzonych w skali przemysłowej – obecnie jednak zastępuje się go innymi rozpuszczalnikami, o ile tylko istnieje taka możliwość.
Toksyczność i metabolizm
Benzen podejrzewany o toksyczność był już w roku
1900
. Powoduje on zarówno ostre jak i przewlekłe
zatrucia
. Zazwyczaj do zatrucia dochodzi poprzez wdychanie par przez
układ oddechowy
, jednak możliwa jest również absorpcja przez
skórę
i wchłanianie wraz z
pokarmem
. Około 6,4 g/m³ powoduje ostre zatrucie w ciągu
godziny
inhalacji
, zaś dawka 10 krotnie większa powoduje natychmiastowy
zgon
.
Ostre zatrucie benzenem charakteryzuje się podrażnieniem skóry, rumieniem, odczuciem palenia, powstawaniem
pryszczy
. Benzen oddziałuje na
centralny układ nerwowy
powodując pobudzenie lub
depresje
, niewydolność układu oddechowego, a w rezultacie zgon. Charakterystycznymi objawami sa też: krwawienia z błon śluzowych, szybki i płytki oddech, drżenie kończyn, zaburzenia rytmu serca.
Dużo częstsze są zatrucia przewlekłe. Pierwsze objawy są niespecyficzne, są to
zmęczenie
,
ból
głowy, utrata
apetytu
. Dokładniejsze badania wykazują nieprawidłowości w składzie biochemicznym
krwi
. Najczęściej dochodzi do obniżenia liczby
białych ciałek krwi
co powoduje spadek odporności i
płytek krwi
. Benzen również działa niszcząco na
szpik kostny
i może powodować
białaczkę
lub
raka
. Pary benzenu po dostaniu się do
płuc
absorbowane są przez
krew
, z której w dużym stopniu wchłaniane są przez
tkanki tłuszczowe
.
Niemetabolizowany benzen wydalany jest przez
płuca
.
Metabolizm
benzenu zachodzi przede wszystkim w
wątrobie
. Najpierw benzen ulega
utlenieniu
w wyniku działania
enzymów
cytochromu P-450
do oksepinobenzenu który jest utrzymywany w stanie
równowagi dynamicznej
z epoksybenzenem. Epoksybenzen może ulec
uwodnieniu
w wyniku działania enzymu hydrolazy epoksydowej dając benzeno-trans-dihydro-1,2-diol, następnie związek ten pod wpływem enzymu dehydrogenazy dihydrodiolowej przekształcany jest w
katechol
. Oksepinobenzen może również reagować poprzez otwarcie pierścienia, dając jako produkt mukonoaldehyd i kwas trans-mukonowy
Niektóre metabolity są odpowiedzialne za działanie toksyczne benzenu. Na przykład główne działanie kancerogenne wykazują kwasy mukonowe powstające jako metabolity.
Bibliografia
- S.E.Manahan "Toksykologia środowiska aspekty chemiczne i biologiczne",
PWN
,
Warszawa
, 2006,
Przypisy