|
|
|
Stężenie (chemia)
Stężenie (chemia)Stężene - miara ilości jednego
pierwiastka
,
związku chemicznego
lub
jonu
w: Stężenie może odnosić się do: - fazy stałej (roztwory stałe, związki chemiczne, mieszaniny, żele)
- fazy ciekłej - w przypadku roztworów zawierających jeden ze składników dużym nadmiarze
- fazy gazowej (mieszaniny gazowe, aerozole itp.).
Stężenie bywają podawane w różnych jednostkach. Do najbardziej znanych należą: -
Stężenie molowe
- liczba moli substancji "s" w jednostce objętości roztworu "V"
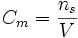 (jednostka: mol/dm3) (jednostka: mol/dm3)- Aby przeliczyć stężenie molowe na dowolne inne jednostki konieczna jest znajomość gęstości roztworu, gdyż stężenie molowe nie zależy od tego czy i jaka substancja znajduje się w tej samej objętości co substancja rozpuszczona; 1 mol CO2 rozpuszczony w 1 dm3 wody lub zajmujący taką samą objętość w fazie gazowej ma to samo stężenie, 1 mol/dm3).
- Stężenie molarne (molalne) - liczba moli substancji rozpuszczonej "s" w 1 kg rozpuszczalnika "r"
 (jednostka: mol/kg) (jednostka: mol/kg)- Rozpuszczalności związków chemicznych w wodzie są często podawane w podobny sposób, t.j. w g/100 g wody lub g/100 cm3 wody; dla rozcieńczonych roztworów wodnych liczbowo prawie równe stężeniu molowemu).
- Stężenia określone poprzez ułamek ilości substancji obecnych w układzie, gdzie suma ułamków jest równa jedności, dzięki czemu wystarczy znać stężenia (k-1) składników dla k-składnikowej mieszaniny:
 oraz oraz 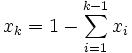
-
ułamek molowy
podaje jaką część liczby cząsteczek danego układu k-składnikowego stanowią cząsteczki danej substancji "s" (n - liczby moli składników):

-
ułamek wagowy
- stosunek masy rozpuszczonej substancji "s" do masy całego roztworu (m - masy składników),

-
ułamek objętościowy
, (xv) - stosunek objętości rozpuszczonej substancji do objętości całego roztworu
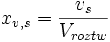 gdzie gdzie 
-
Stężenie procentowe
Cp jest to właściwie ułamek (najczęściej wagowy) wyrażony w %, Cp = x·100%. Stężenie procentowe wagowe często oznacza się symbolem %w/w a stężenie procentowe objętościowe %v/v (np. alkohole). W praktyce wykorzystuje się również promile.
Szczególnie niskie stężenia podaje w jednostkach zwanych
ppb
,
ppm
i
ppt
, które również z formalnego punktu widzenia są rodzajem ułamków (molowych, wagowych lub objętościowych). Objętość nie jest
wielkością addytywną
przy mieszaniu substancji. Z reguły objętość roztworu jest mniejsza niż suma objętości składników. Z tego powodu dla wielu mieszanin objętość roztworu jest jedynie w przybliżeniu równa sumie objętości składników. Np. dla mieszaniny alkohol etylowy/woda na skutek tzw.
kontrakcji
ta różnica sięga 2% objętości. Zjawisko kontrakcji powoduje, że nie można prosto przeliczać stężeń masowych na molowe.
Inne hasła zawierające informacje o "Stężenie (chemia)":
Iloczyn
...
Nadciśnienie tętnicze
...
Oddychanie komórkowe
...
Fosforan wapnia
...
Wskaźnik
...
Grupa
...
Zawał mięśnia sercowego
...
Związek organiczny
...
Chemoklina
...
Oksyklina
...
Inne lekcje zawierające informacje o "Stężenie (chemia)":
Aldehydy i ketony (plansza 33)
...
Węglowodory aromatyczne. Areny (plansza 24)
...
028. Ekologia – zależności między organizmami i środowiskiem (plansza 23)
...
|
|
|
|